Bases de chimie. 2. Les orbitales
Commençons par la notion d’orbite atomique. Les électrons interagissent entre eux et, dans le même temps, sont attirés par le noyau alors la localisation des électrons est modélisée en physique quantique sur des couches énergétiques chacune ayant une ou plusieurs sous-couches.
Les calculs mathématiques ont permis de modéliser les orbites atomiques et de les nommer selon les couches orbitales :
- Première couche (K) : 1 sous-couche électronique s nommée 1s
- Deuxième couche (L) : 1 sous-couche s et 1 p contenant (du fait de sa configuration tridimensionnelle) 3 emplacements (orbitales). La couche est désignée par 2s 2p
- Troisième couche (M) : 1 sous-couche s, 1 p et 1 d contenant 5 emplacements. La couche est désignée par 3s 3p 3d.
Il n’est pas forcément utile d’aller plus loin.
Chaque sous-couche possède une ou plusieurs orbitales dépendant de la configuration en trois dimensions de ces orbitales représentées sous forme de cases.
Pour donner la configuration électronique des atomes, à leur état fondamental (état d’énergie atomique le plus bas possible), on se base sur 2 principes et 1 règle :
- Le principe d’exclusion de Pauli : chaque orbitale ne peuvent contenir que 2 électrons représentés par deux flèches.
- Le principe d’énergie minimum (principe du Aufbau) : Les orbitales d’énergies les plus basses sont remplies en priorité. Pour que les trois premières couches se remplissent totalement, la représentation devient :
Comme vous pouvez le constater, il faut remplir la sous-couche s de la quatrième couche avant de passer à la sous-couche d de la troisième.
- La règle de Hund : dans une même sous-couche, les électrons utilisent prioritairement toutes les orbitales disponibles avant de s’apparier, car c’est la solution la moins énergétique. C’est-à-dire qu’avant de remplir la sous-couche 2p il faut absolument avoir rempli la 2s avec 2 électrons.
Bon… et maintenant ? Cela va nous être utile pour comprendre non seulement la formation des liaisons chimiques mais aussi les possibilités de leur possibilité.
Des exemples :
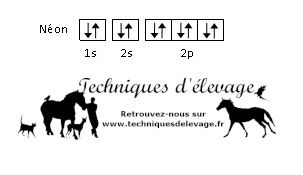
- Le Néon (Ne) (le plus intéressant pour la suite) : 10 protons donc 10 électrons puisque c’est un gaz noble :
- L’oxygène (O) : 8 électrons
- L’azote (N) : 7 électrons
François Kaeffer
Découvrez le poster sur Les grandes voies métaboliques réalisé par TE
Pour commander une de nos publications, utiliser l’onglet "Commander un de nos produits" en haut de cette page ou connectez-vous sur notre site.
La garantie de l'expertise, le choix de l'indépendance